グリア細胞とは何か?―認知症薬と認知症対応の最新動向―
2019/07/25
今月初め、日本経済新聞で、富士フィルムがグリア細胞に狙いを定めたアルツハイマー病薬の治験を今夏にも欧州で始めると報道がありました。
原文へのリンク
認知症薬「脳を掃除」に注目 グリア細胞、老廃物を除去 新発想で開発停滞打破へ|日本経済新聞2019/7/1付(有料会員限定記事)
グリア細胞とは何か?
脳は神経細胞(ニューロン)及びそれとは区別されたグリア細胞から構成されていて、人間の脳ではグリア細胞が神経細胞の10倍以上存在するとみられています。
グリア細胞のうち「ミクログリア」には、脳にたまる老廃物であるアミロイドβの除去機能があります。
富士フィルムはそこに期待をかけたことになります。
この日経新聞の記事ではさらに、グリア細胞のうち「アストロサイト」がアミロイドβを分解する酵素を分泌していることを突き止めたと紹介されています。
ミクログリアにせよ、アストロサイトにせよ、共通しているのは、アミロイドβの産生・蓄積の側ではなく、分解・除去の側に機能しているということです。

アミロイド仮説とは何か?
アミロイド仮説ではアルツハイマー病の病理は以下のように説明されています。
このアミロイド仮説に基づき、蓄積されたアミロイドβを破壊することが、アルツハイマー病の効果的な治療法であり、予防法であると考えられてきました。
アミロイド仮説に基づく新薬の開発動向
現在進行している認知症新薬の開発は、アミロイド仮説に基づいています。
そして、薬の機能により2つに分類されます。
すなわち、アミロイドβに結合し、取り除き減少させることに資する「抗アミロイドβ抗体」と、アミロイドβが生成されるプロセス(注:アミロイドβはその前段階のタンパク質であるAPPが部分切断されることで生成される)を阻害する「BACE阻害剤」に二分されます。しかし、今のところ成功を収めたものはありません。
エーザイはこれまで3つの認知症治療薬候補の治験を進めてきましたが、今年の3月に1つの治験を中止すると発表しました(「エーザイ、別の認知症薬に望みつなぐ 最終治験を開始 | 日本経済新聞2019/3/22付←リンクあり」)。
中止されたのは「アデュカヌマブ」で、抗アミロイドβ抗体に分類されます。残されたのは、抗アミロイドβ抗体の「BAN2401」、BACE阻害剤の「エレンベセスタット」の2つになっています。
既存の認知症薬はどのようなものか?
アミロイド仮説に基づく新薬の開発はまだ治験中の段階と言うことですが、現在日本で販売されている認知症治療薬はどのようなものでしょうか?
1つは神経伝達物質であるアセチルコリンが分解されないようにすることを目指し、その分解酵素であるコリンエステラーゼの働きを阻害するものです。
アルツハイマー病ではアセチルコリンが減少します。それゆえ、薬が機能すれば神経細胞(ニューロン)と神経細胞(ニューロン)をつなぐシナプスのアセチルコリン残量が増えます。
製品名で言うと、アリセプト、レミニール、イクセロン、リバスタッチが該当します。
もう1つはグルタミン酸という神経伝達物質の受容体であるNMDA受容体の過剰な活性化を抑えるものです。
アルツハイマー病ではグルタミン酸の過剰な放出とともに、グルタミン酸と結合したNMDA受容体(NMDA型グルタミン酸受容体)の過剰な活性化がみられることにより、神経細胞の障害や記憶・学習機能の障害があらわれると言われています。
製品名で言うとメマリーです。
注:一つひとつの神経細胞(ニューロン)には、「軸索」と呼ばれる長いケーブルがあり、この軸索の中をイオンの交換に基づく電気信号が伝わります。信号が軸索の末端まで伝わると、軸索の末端にあるシナプスを通じて、次の神経細胞に信号を伝えます。シナプスと次の神経細胞との間には「シナプス間隙(かんげき)」と呼ばれる小さな隙間があり、直接つながっていません。そのために電気信号を直接伝えることはできず、シナプスから神経伝達物質を放出することで、次の神経細胞を刺激させて信号を伝えています。
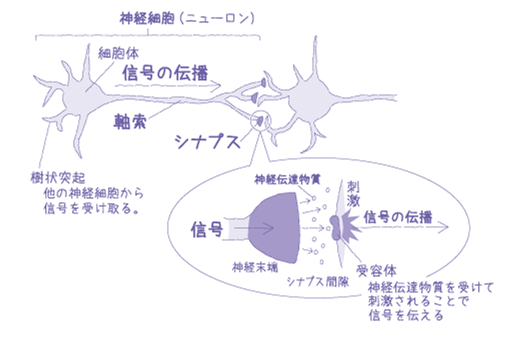
出典:画像は医療法人社団ハートクリニックのサイト(←リンクあり)より入手。
(画像を見ながら確認されたい点→軸索の中は電気信号が伝わる。神経細胞の末端(シナプス)から次の神経細胞へは神経伝達物質が情報を伝える。)
フランスでは認知症薬は保険適用外に
昨年、フランスで上記の認知症薬が医療保険の適用外となりました。副作用の割に効果が高くなく、薬の有用性が不十分だと判断されたとのことです。
このことを伝える朝日新聞の記事タイトルは『抗認知症薬の効果「不十分」仏、4種類を保険適用外に』(←リンクあり。有料会員限定)です。
4種類は成分名での分類です。成分名と日本での製品名との対応関係は以下の通りです。
| 成分名 | 日本での商品名 |
| ドネペジル | アリセプト |
| ガランタミン | レミニール |
| リバスチグミン |
イクセロン |
| メマンチン | メマリー |
コメント1―グリア細胞とアミロイド仮説―
富士フィルムがグリア細胞に注目したアルツハイマー病薬の治験を始めるとのことですが、グリア細胞のアミロイドβを除去する機能に着眼したということですから、この挑戦も引き続きアミロイド仮説に則っていると言えると思います。
アミロイドβを除去するのにグリア細胞に光を当てたという点が新しいのではないかと思います。
最初に引用した日経新聞の記事では、アミロイド仮説が揺らいでいると書かれています。それは、いまだ成功を収めておらず、エーザイで1つの治験が中止されたことなどを受けてのものと思います。また、権威ある医学雑誌(JAMA)の最近の記事で、(アミロイド仮説に基づく)BACE阻害剤に分類されるベルベセスタットをMCI(アルツハイマー病の前段階と考えられる)で、かつ、脳内のアミロイドβの増加が認められる参加者に対して投与したところ、脳内のアミロイドβの量を減少させた一方で、認知機能の低下を抑制できなかった結果が報告されています。
(Another Amyloid-beta Blocker Fails to Halt Dementia. JAMA 2019;321(24):2396 | JAMAという医学雑誌のサイトより)
グリア細胞はアミロイドβを分解・除去するということですから、新薬の開発で言うところの「抵アミロイドβ抗体」(アミロイドβに結合し、取り除き減少させることに資する)の発想に近しく聞こえます。既存のアミロイドβ除去とグリア細胞によるアミロイドβ除去がどれほど異なり、それが画期的なものかは素人の私には分かりかねますが、科学の進展には期待したいですし、その動向は注意深く追いかけていきたく思います。
コメント2―リコード法とアミロイド仮説―
新薬は「アミロイドβ抗体」と「BACE阻害剤」に分類されると記しました。
このうちBACE阻害剤はAPPというタンパク質からアミロイドβ(というタンパク質)が生成されるプロセスを阻害するものです。
カフェストでも何度か取り上げているアルツハイマー病予防のためのリコード法の説明では、AAP(注:アミロイド前駆体タンパクという意味、つまり、アミロイドβの素になるタンパクという意味)についても言及されています。
それによれば、
APPは3か所で切断される場合と1か所で切断される場合の2つの場合があります。
APPが3か所で切断されたときの4つの断片の1つがアミロイドβです。そして、この4つの断片は脳の神経細胞を破壊していきます。
一方、1か所で切断され2つの断片ができたときは神経細胞を維持し、成長させます
| APP切断数 | 脳の神経細胞 |
| 3つ | 破壊 (アルツハイマー病進行) |
| 1つ | 維持 (アルツハイマー病抑制) |
リコード法を提唱するブレデセン教授は次のように言っています。
アルツハイマー病のリスクを減らすには、アルツハイマー病の原因となる、4人組を最小にし、アルツハイマー病を防ぐ2人組を最大限にしなくてはならない。言うまでもなく、ただ念じれば二人組が増えるわけではない。だが、リコード法を実践すれば、実現できる。
そして、プレデセン教授は、APPがアルツハイマー病を引き起こすのに少なくとも36の異なる原因が特定されたと言っています。認知症薬に関してはは36個の原因のうちの数個に対応するに止まり、限界があると言われています。
グリア細胞に狙いを定めた薬と、上記のリコード法に基づく説明とはどのような関係にあるでしょうか?グリア細胞に狙いを定めた薬は、生成されたアミロイドβを除去してくるもののようですが、記事を見る限りは、APPの切断数の違いに起因する、脳の神経細胞を破壊する側に向かうのか、維持・成長する側に向かうのかというバランスに関わるものではないように思われます。
コメント3―認知症薬と認知症対応の最新動向―
本年6月、厚生労働省より「高齢者の医薬品適正使用の指針(各論編(療養環境別))について」(←リンクあり)の通知が出されました。
医薬品の適正使用に関する指針ということですが、非薬物的対応の重要性という項目が設けられ、生活習慣の改善、環境調整、ケアの工夫の重要性が指摘されている点が大事な点ではないかと思います。
高齢者は、薬物有害事象によって、ふらつき、転倒、食欲低下、便秘、抑うつ、認知機能低下といった老年症候群が生じることがあり、そのリスク回避のためにも、薬物療法に先んじて患者の状態に応じた実施可能な手段を講じることが推奨される。
認知症の高齢者に対しても、「緊急対応が求められる場合を除き、まずは非薬物的対応を行うことが望ましい」と指摘されています。
魔法の薬はさすがになく、「長期間服用しても状態の改善が認められない場合は、非薬物的対応への切り替えを検討する」と指摘されていますが、その一方で「非薬物的対応では効果が不十分又はそれらの実施が困難と考えられた場合、薬物療法への切り替えを検討する」とも指摘されています。
これらから浮かび上がるのは、認知症薬と、(薬に頼らない)生活習慣の改善、環境調整、ケアの工夫などの非薬物的な認知症対応の適切な併用や切り替えが標準と考えられていることではないかと思います。
コメント4―ブレデセン教授の言葉「薬はデザート」とまとめ―
リコード法を提唱したブレデセン教授の以下の言葉も、この考え方―薬と薬以外の対応の併用、切り替え―に沿っていると思います。
今から20~30年前に、仮に誰かが私に「神経学の研究者として、瞑想、ヨガ、笑うこと、音楽、喜び、絶食、運動、ハーブ、栄養、睡眠を含めたプロトコルをあなたは推奨しているだろう」と言ったら、一笑に付していただろう。
アルツハイマー病への鍵となる一個の特異的分子を最終的に特定することを目指していたブレデセン教授が20~30年後にアルツハイマー病予防の鍵として語るようになったのは、笑うことであり、音楽であり、喜びなどであるということです。
薬に対しては「デザートであってメインディッシュではない」と言われ、薬剤の試験も「薬+リコード法」を組み合わせた効果の検討が最善ではないかという趣旨のことを言われています。
偏りなく、認知症薬と(薬以外の)生活習慣の改善、環境調整、ケアの工夫などを組み合わせて、対応を考えていくことの重要性が繰り返し説かれていると思います。
(文:星野 周也)
<認知症Cafést内関連記事>
<参考文献>
・デール・ブレデセン著『アルツハイマー病 真実と終焉』(2018年)
・道険し認知症の根治薬開発, 週刊東洋経済2018/10/13付 第6819号: pp.20-22
・秋山治彦, Aβ沈着とミクログリア, 老年期痴呆研究会誌 Vol.15 2010: pp.79-81
<参考記事・サイト>
・アルツハイマー病のアミロイドβ仮説は死んだのか?(2017年)|日経バイオテクONLINE
・高齢者では「今の状態」に合わせた薬剤調整を(2019年)|日経メディカル
・アストロサイトがアルツハイマー病の病態形成に関わっていることを発見|国立研究開発法人 日本医療研究開発機構プレスリリース 平成30年1月8日




